| Bekijk deze e-mail in je browser |
Beste lezer,
Hierbij ontvangt u de Nieuwsbrief voor Goede Onderzoekspraktijken van 8 april 2017, met de laatste ontwikkelingen rond medisch-wetenschappelijk onderzoek met mensen, nieuwe wet- en regelgeving en gereviseerde richtlijnen.
In deze nieuwsbrief zijn voor een laatste maal alle publieke consultaties en bijeenkomsten opgesomd die bij mij bekend zijn. Omwille van de leesbaarheid van de nieuwsbrief heb ik besloten om los van de nieuwsbrief eenmaal per maand een overzicht van publieke consultaties en bijeenkomsten te versturen. In de nieuwbrief zullen voortaan geen overzichten meer worden opgenomen maar alleen de recent geopende consultaties en de bijeenkomsten die nog niet eerder bij mij bekend waren.
Wilt u naast de nieuwsbrief ook eenmaal per maand een overzicht van consultaties en bijeenkomsten per e-mail ontvangen? Klik hier om uw voorkeuren bij te werken!
Voor vragen, verzoeken en nieuwstips kunt u mij bereiken door te antwoorden op deze e-mail of via het contactformulier op de website.
Met vriendelijke groet,
Inhoudsopgave
- CCMO meldt vertraging bij beoordeling amendementen door Bevoegde Instantie
- Geconsolideerde tekst van gewijzigde Wet medisch-wetenschappelijk onderzoek met mensen in verband met de uitvoering van verordening 536/2014 op het gebied van klinische proeven met geneesmiddelen voor menselijk gebruik
- Verordeningen voor medische hulpmiddelen en medische hulpmiddelen voor in-vitrodiagnostiek door Europees Parlement aangenomen
- Bijeenkomsten
- Publieke consultaties
- Uitgelicht
Onderzoek met Geneesmiddelen
CCMO meldt vertraging bij beoordeling amendementen door Bevoegde Instantie
Op 7 april 2017 maakte de CCMO via haar website bekend dat er momenteel sprake is van vertraging bij de beoordeling van amendementen door de Bevoegde Instantie (BI).
Er is niet aangegeven met hoeveel vertraging indieners rekening moeten houden. Ook is niet aangegeven wanneer men verwacht dat de vertraging is verholpen.
Wel biedt de Bevoegde Instantie aan om amendementen met voorrang te behandelen als er sprake is van urgentie.
Geconsolideerde tekst van gewijzigde Wet medisch-wetenschappelijk onderzoek met mensen in verband met de uitvoering van verordening 536/2014 op het gebied van klinische proeven met geneesmiddelen voor menselijk gebruik
Op 21 maart 2017 heeft de Eerste Kamer het voorstel tot wijziging van de Wet medisch-wetenschappelijk onderzoek met mensen en de Geneesmiddelenwet in verband met de uitvoering van verordening 536/2014 op het gebied van klinische proeven met geneesmiddelen voor menselijk gebruik aangenomen. De wet is nog niet gepubliceerd in het Staatsblad.
Omdat er vooralsnog geen geconsolideerde wettekst beschikbaar is heb ik de moeite genomen om zelf een geconsolideerde tekst te produceren aan de hand van de tekst van de Wet medisch-wetenschappelijk onderzoek met mensen (tekst geldend op 1 maart 2017) en het gewijzigd voorstel van wet d.d. 23 februari 2017.
Onderzoek met Medisch Hulpmiddelen
Verordeningen voor medische hulpmiddelen en medische hulpmiddelen voor in-vitrodiagnostiek door Europees Parlement aangenomen
Het Europees Parlement heeft afgelopen woensdag 5 april de "Verordening (EU) van het Europees Parlement en de Raad betreffende medische hulpmiddelen, tot wijziging van Richtlijn 2001/83/EG, Verordening (EG) nr. 178/2002 en Verordening (EG) nr. 1223/2009 en tot intrekking van Richtlijnen 90/385/EEG en 93/42/EEG van de Raad" en de "Verordening (EU) van het Europees Parlement en de Raad betreffende medische hulpmiddelen voor in-vitrodiagnostiek en tot intrekking van Richtlijn 98/79/EG en Besluit 2010/227/EU van de Commissie" aangenomen (bron: European Commission, press release; European Parliament press release, 5 april 2017).
"De nieuwe regels worden pas van toepassing na de bekendmaking in het Publicatieblad. Voor de nieuwe wetgeving inzake medische hulpmiddelen is dat na 3 jaar [2020], en voor de nieuwe wetgeving inzake medische hulpmiddelen voor in‑vitrodiagnostiek na 5 jaar [2022]." (Bron: Raad van de EU, Modernisering van EU-regels voor medische hulpmiddelen, 6 april 2017)
Op dit moment is er nog weinig bekend over hoe een en ander in Nederland ingevuld gaat worden. Het wachten is nu op de nieuwe Minister van VWS om met een voorstel te komen tot wijziging van de Wet op de medische hulpmiddelen, Besluit medische hulpmiddelen en Besluit in-vitro diagnostica in verband met de uitvoering van de nu aangenomen EU verordeningen.
Op een speciale themapagina over de Europese verordeningen medische hulpmiddelen en in-vitro diagnostica geeft de CCMO aan dat zij samen met het ministerie van VWS, IGZ en het RIVM werken aan een implementatieplan (bron: CCMO, z.d.).
Zoals ook aangegeven op de Invitational conference 'Klinisch onderzoek met medische hulpmiddelen' van 15 december 2016 verwacht de CCMO dat zij een belangrijke coördinerende rol gaat spelen bij het aanmelden en beoordelen van klinisch onderzoek met medische hulpmiddelen (bron: IGZ, verslag invitational conference; CCMO, z.d.).
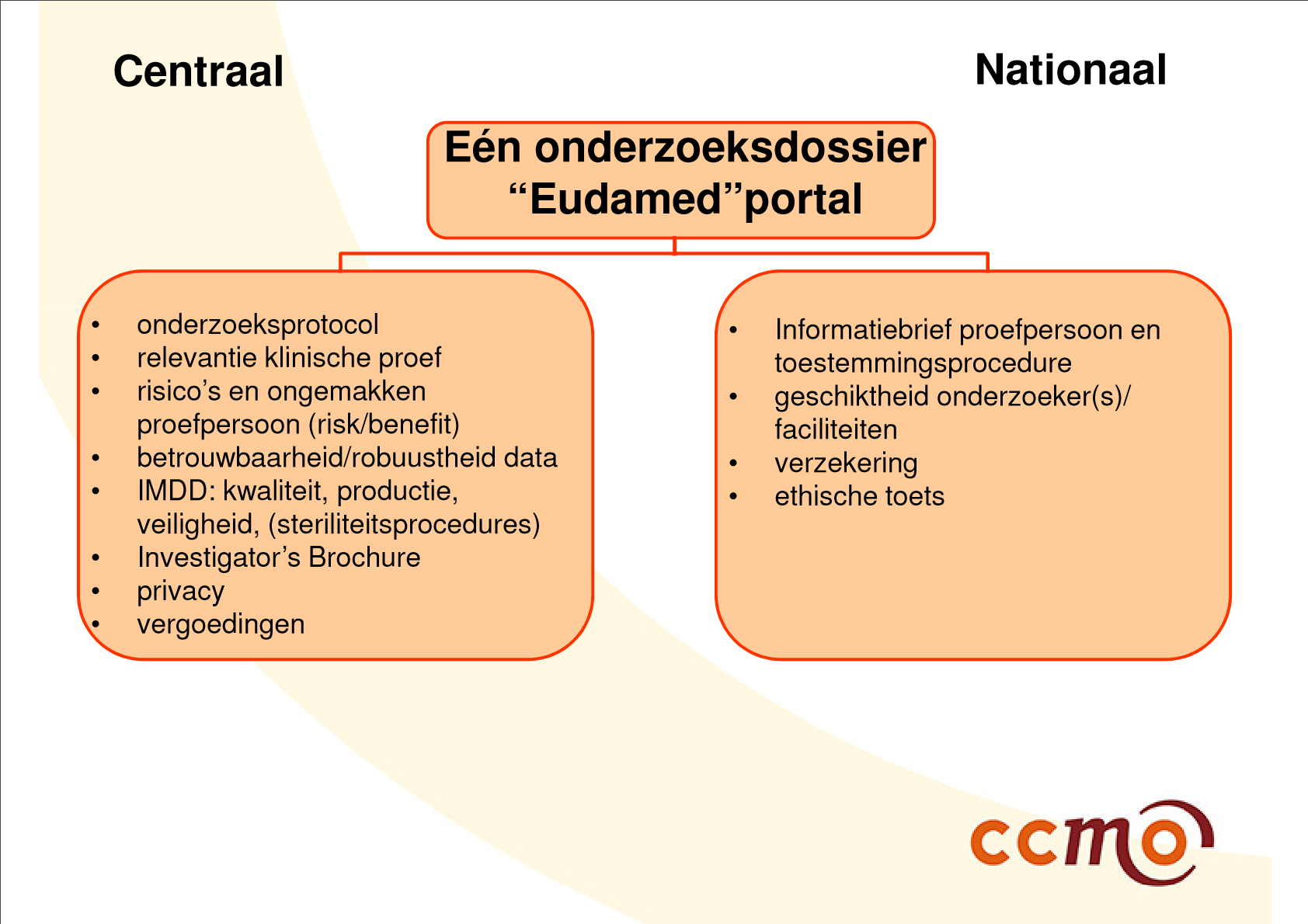 |
 |
| Slide 21 en 22 uit presentatie van Al, M. (15 december 2016). Klinisch onderzoek met medische hulpmiddelen: de rol van de METC. Centrale Commissie Mensgebonden Onderzoek, gegeven op Invitational conference 'Klinisch onderzoek met medische hulpmiddelen' van 15 december 2016, georganiseerd door de Inspectie voor de Gezondheidszorg (IGZ). | |
De tijd zal het leren of het uiteindelijke proces van valideren en beoordelen van klinisch onderzoek met medische hulpmiddelen onder de nieuwe verordeningen overeenkomt met het proces zoals werd geschetst ten tijde van de invitational conference van 15 december 2016 (zie bovenstaande afbeeldingen).
Eén ding zal voor iedereen duidelijk zijn, net als bij de implementatie van de verordening voor klinische proeven met geneesmiddelen zullen ook deze verordeningen van alle betrokken partijen de nodige inspanningen vragen om tot een succesvolle implementatie te komen.
Download de verordeningen (nog niet gepubliceerd):
- Verordening (EU) 2017/… van het Europees Parlement en de Raad van 5 april 2017 betreffende medische hulpmiddelen, tot wijziging van Richtlijn 2001/83/EG, Verordening (EG) nr. 178/2002 en Verordening (EG) nr. 1223/2009 en tot intrekking van Richtlijnen 90/385/EEG en 93/42/EEG van de Raad
- Verordening (EU) 2017/… van het Europees Parlement en de Raad van 5 april 2017 betreffende medische hulpmiddelen voor in-vitrodiagnostiek en tot intrekking van Richtlijn 98/79/EG en Besluit 2010/227/EU van de Commissie
Omwille van het gemak en de leesbaarheid heb ik van hoofdstuk VI (klinische evaluatie en klinische onderzoeken) en bijlage XV (klinisch onderzoek) van de verordening betreffende medische hulpmiddelen 'losse' pdf-bestanden gemaakt. Deze bestanden zijn te downloaden met behulp van de links hieronder:
Lees verder
- CCMO themapagina "Europese verordeningen medische hulpmiddelen en in-vitro diagnostica"
- IGZ medische technologie "klinisch onderzoek met medische hulpmiddelen"
- Al, M. (15 dec. 2016). Klinisch onderzoek met medische hulpmiddelen: de rol van de METC. Slide 21-22 uit CCMO presentatie gegeven op Invitational conference 'Klinisch onderzoek met medische hulpmiddelen' van 15 december 2016, georganiseerd door de Inspectie voor de Gezondheidszorg (IGZ).
- Verslag IGZ Invitational conference van 15 december 2016
20 april 2017 - NVFG ClinOpsDag 2017
Locatie: Hotel Veenendaal, van der Valk
21 april 2017 - DARQA ICT-themadag: ICT in het GXP-domein
Locatie: Regardz De Eenhoorn, Amersfoort
2 mei 2017 - Joint EFGCP-EFPIA Multi-Stakeholder Workshop on Communicating Clinical Trial Results to meet Public Needs - Working towards Implementation of Lay Summaries
Locatie: Crowne Plaza Le Palace, Brussels, Belgium
10 mei 2017 - Vereniging Innovatieve Geneesmiddelen organiseert 'Kennisatelier' in het kader van het toetsingskader voor niet-WMO studies
De Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma) organiseert op 10 mei 2017 een bijeenkomst met de titel "Kennisatelier het toetsingskader voor nWMO studies – ervaringen met de nieuwe procedure"
Deze bijeenkomst is ook toegankelijk voor "niet-leden".
28 - 31 mei 2017, 5th World Conference on Research Integrity
Locatie: Vrije Universiteit Amsterdam
9 juni 2017 - DCRF en ACRON organiseren workshop over procedure lokale uitvoerbaarheid
DCRF en ACRON organiseren samen een workshop over de procedure lokale uitvoerbaarheid.
16 juni 2016 - FederaDag 2017 Too valuable to waste: Experiments on humans and animals
Locatie: Laan van NOI 300, Den Haag
EMA: ICH E11(R1) guideline on clinical investigation of medicinal products in the pediatric population: Step 2b
Consultatie open tot 13 april 2017
OECD: Sustainable access to innovative therapies
Consultatie open tot 1 mei 2017
EMA: Concept paper on developing a guideline on quality requirements of medicinal products containing a device component for delivery or use of the medicinal product
Consultatie open tot 16 mei 2017
EMA: Consultation on revised policy on access to documents (POLICY/0043)
Consultatie open tot 18 mei 2017
EMA: Draft reflection paper providing an overview of the current regulatory testing requirements for medicinal products for human use and opportunities for implementation of the 3Rs
Consultatie open tot 31 mei 2017
EMA: Concept paper on a revision of the guideline on the investigation of drug interactions
Consultatie open tot 30 juni 2017
EMA: Concept paper on the need to revise Condition – Specific guidance, Appendix 4 to the guideline on the evaluation of anticancer medicinal products in man
Consultatie open tot 30 juni 2017
EMA: Draft guideline on equivalence studies for the demonstration of therapeutic equivalence for products that are locally applied, locally acting in the gastrointestinal tract as addendum to the guideline on the clinical requirements for locally applied, locally acting products containing known constituents
Consultatie open tot 30 september 2017
EMA: Draft guideline on multiplicity issues in clinical trials
Consultatie open tot 30 september 2017
EMA: Draft reflection paper on statistical methodology for the comparative assessment of quality attributes in drug development
Consultatie open tot 31 maart 2018
Notificaties aanpassen
U kunt zelf uw voorkeuren aanpassen en aangeven welke notificaties u per e-mail wilt ontvangen.
|
Corsello, S.M. et al. (7 April 2017). The Drug Repurposing Hub: a next-generation drug library and information resource. Nature Medicine 23, 405–408 (2017) doi:10.1038/nm.4306 |
|
Gelinas L, Lynch HF, Bierer B, et al (6 April 2017). Institutions as an ethical locus of research prioritisation. Journal of Medical Ethics doi: 10.1136/medethics-2017-104165 |
|
Editorial (6 April 2017). Europe must find a new home for its drug regulator — and a way to keep using English. Nature 544, 6 doi:10.1038/nature.2017.21762 |
|
EMA news (6 April 2017). Optimising safety information for medicines in Europe throughout product lifecycle. New guidance and process improvement for periodic safety update reports. |
|
Maxmen, A. (6 April 2017). 23andMe given green-light to sell DNA tests for 10 diseases. Nature doi:10.1038/nature.2017.21802 |
|
Treatments, How Flawed Science Is Undermining Good Medicine (6 April 2017). NPR, Shots health news from NPR. |
|
PubMed Commons Team (6 April 2017). Authors alerting readers via PubMed Commons. PubMed Commons blog. |
|
Neuroskeptic (5 April 2017). The Trouble With The “Journal of Stem Cells”. Discover, blogs. |
|
McCook, A. (5 April 2017). Most citations to retracted papers don’t note they’re problematic, authors say. Retraction Watch. |
|
Yu Shrike Zhang, Yi-Nan Zhang, Weijia Zhang, Cancer-on-a-chip systems at the frontier of nanomedicine, Drug Discovery Today, Available online 5 April 2017, ISSN 1359-6446 |
|
Dalmeet Singh Chawla (4 April 2017). Unpaywall finds free versions of paywalled papers. Nature doi:10.1038/nature.2017.21765 |
|
Woodcock, S. (4 April 2017). Paradoxes of probability and other statistical strangeness. The Conversation. |
|
Kenneth K. Wong et al, Radiotherapy after high-dose chemotherapy with autologous hematopoietic cell rescue: Quality assessment of Head Start III, Pediatric Blood & Cancer (2017). DOI: 10.1002/pbc.26529 |
|
EMA Press release (3 April 2017). Collaboration with academia to be reinforced. EMA publishes framework and action plan for closer interaction. |
|
EU rapid drug approval plan worries some national agencies (29 March 2017). Reuters, Business News. |
|
Waterval, D. (23 maart 2017). Dé fout in wetenschappelijk onderzoek: veel te weinig proefpersonen. Trouw. |
|
ZonMw nieuws (21 maart 2017). Welke rol hebben onderzoekfinanciers bij verbeteren van kwaliteit en relevantie van wetenschappelijk onderzoek. |
|
Nasser, Mona et al. (11 March 2017). What are funders doing to minimise waste in research? The Lancet , Volume 389 , Issue 10073 , 1006 - 1007 |
|
Farid-Kapadia, M., Joachim, K.C., Balasingham, C., Clyburne-Sherin, A. & Offringa, M. (6 March 2017). Are child-centric aspects in newborn and child health systematic review and meta-analysis protocols and reports adequately reported?—two systematic reviews. Systematic Reviews 2017 6:31 DOI: 10.1186/s13643-017-0423-9 |
|
Lundh A, Lexchin J, Mintzes B, Schroll JB, Bero L. Industry sponsorship and research outcome. Cochrane Database of Systematic Reviews 2017, Issue 2. Art. No.: MR000033. DOI: 10.1002/14651858.MR000033.pub3 |
Copyright © Vincent Bontrop, All rights reserved.
Contactgegevens:
Hopakker - 3514 BZ Utrecht - Netherlands
 |
 |